 Même sans être scientifique, on entend souvent parler de la pression des gaz. A commencer par celle de l'air - qui est bien un gaz - dans les bulletins météo ou quand on gonfle un pneu.
Même sans être scientifique, on entend souvent parler de la pression des gaz. A commencer par celle de l'air - qui est bien un gaz - dans les bulletins météo ou quand on gonfle un pneu.
Et pour cause : la pression règne en maître sur bien des choses...
Elle peut même transformer un gaz en liquide à force d'augmenter.
Mais que veut dire au juste cette mesure ?
Commençons par une expérience imaginaire un peu cruelle...
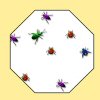
Imaginez des mouches aveugles enfermées dans un bocal...
Au cours de leur vol, elles vont se cogner les unes aux autres et se cogner aux parois.
Et le nombre des chocs va augmenter si vous mettez de plus en plus de mouches dans le bocal, ou si elles se mettent à voler de plus en plus vite.
Quel est le rapport entre ces pauvres mouches prisonnières et un gaz ?
 Enfermons de l'air dans un bocal : il suffit de prendre un bocal vide et de fermer le couvercle, c'est fait !
Enfermons de l'air dans un bocal : il suffit de prendre un bocal vide et de fermer le couvercle, c'est fait !
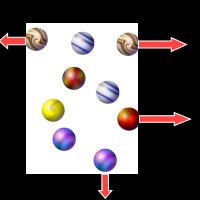 Vous ne voyez rien... mais à l'intérieur du bocal, les molécules de l'air se comportent exactement comme les mouches de notre expérience imaginaire : elles bougent, se cognent les uns aux autres et heurtent les parois.
Vous ne voyez rien... mais à l'intérieur du bocal, les molécules de l'air se comportent exactement comme les mouches de notre expérience imaginaire : elles bougent, se cognent les uns aux autres et heurtent les parois.
L'ensemble de tous ces chocs produit une force sur la paroi.
Et la pression de l'air dans le bocal, c'est la traduction de cette force, en y ajoutant une précision :
on ne compte pas simplement les chocs (la force totale),
mais le nombre de choc sur une surface donnée (un carré de paroi de 1 cm par 1 cm par exemple),
donc la force pour une surface donnée.
Calculer une pression
Pour connaître la pression du gaz dans un espace fermé, on mesure donc la force produite par les chocs (on appelle cette force "F") et on la divise par la surface des parois (on va l'appeler "S") :
la pression P exercée par les atomes sur les parois est P = F / S.
La force se mesure en Newtons [N]. La surface en mètres carrés [m2].
L'unité de mesure d'une pression est donc le Newton par mètre carré [N.m-2] que l'on appelle aussi Pascal (Pa).
Remarquez que :
- Si on double le nombre de molécules dans un même bocal :
F double parce qu'il y a 2 fois plus de chocs sur la paroi.
Mais la surface S reste la même, donc il y a 2 fois plus de chocs sur chaque cm2.
Donc la pression double. - Si on double la surface du bocal en gardant le nombre de molécules :
Il y a le même nombre de molécules, donc le même nombre de chocs : F ne change pas.
Par contre, la surface de paroi a doublé, donc chaque cm2 du bocal reçoit 2 fois moins de chocs.
Donc la pression est divisée par 2.
Mais mesurer la force F sur la paroi n'est pas pratique...
Si la pression dépend bien de la surface des parois et de la force que les molécules y exercent, il est très difficile dans la vie courante de mesurer cette force...
Mais en réfléchissant un peu, on peut trouver une autre façon de calculer la pression en regardant de près comment elle dépend du nombre de choc observé sur une surface donnée.
Il faut tenir compte :
- du nombre de molécules N (plus il y a de molécules, plus il y a de chocs),
- de leur agitation (plus les molécules bougent, plus elles se cognent aux parois) donc, en fait, de leur température T (car plus les molécules ont chaud plus elles s'agitent ... et vice-versa !),
- de la taille de la surface sur laquelle elles viennent se heurter (10 chocs sur 1 m2 produisent une pression plus grande que 10 chocs sur 2 m2 car cela ne fait que 5 chocs sur 1 m2) donc du volume V dont elles disposent.
Si il y a une quantité "raisonnable" de molécules, avec ces mesures de N, V et T (plus faciles à faire),
on peut alors calculer la pression grâce à une relation très célèbre,
qui s'appelle la "loi des gaz parfaits" :
|
P = N x R x T / V où R est une constante (c'est à dire un nombre). |
En savoir plus sur |
Du gaz qui devient liquide quand la pression est trop forte ?
Les molécules de gaz ont un inconvénient : elles prennent toujours toute la place disponible !
Il n'y a qu'à regarder la vapeur d'eau qui s'échappe d'une casserole d'eau bouillante pour s'en convaincre. Et les molécules d'air emprisonnées dans un bocal adoreraient vagabonder dans un bocal deux fois plus grand.
Mais les gaz ont aussi un avantage : on peut les "concentrer" en mettant beaucoup de molécules dans un petit espace.
Comme l'air sous pression qui est "concentré" dans la chambre à air d'un pneu de vélo ou de voiture : on y met 2 ou 3 fois plus de molécules que dans l'air ambiant (en utilisant une pompe à vélo).
Mais on peut aller plus loin... et mettre tellement de molécules de gaz dans un petit espace que - trop à l'étroit - les molécules se collent les unes aux autres et deviennent en fait un liquide.

 Ca vous dit quelque chose ? Mais oui, c'est le principe des bouteilles de gaz raccordées aux cuisinières : "libre", le butane est un gaz, mais une bonbonne de gaz renferme du butane sous pression devenu liquide à force d'être comprimé.
Ca vous dit quelque chose ? Mais oui, c'est le principe des bouteilles de gaz raccordées aux cuisinières : "libre", le butane est un gaz, mais une bonbonne de gaz renferme du butane sous pression devenu liquide à force d'être comprimé.
Résultat : une fois libéré - grâce au détendeur accroché à la bouteille - il deviendra des dizaines de mètres cube de gaz se consumant sous la casserole alors qu'il ne prend que très peu de place sous forme liquide.
D'autres exemples courants dans les maisons sont les briquets (avec du gaz liquide) et les recharges de CO2 utilisées pour gazéifier l'eau et faire des sodas.









 Vous avez une question... et Archi7 n'y a pas encore répondu ?
Vous avez une question... et Archi7 n'y a pas encore répondu ?